С появлением новых европейских регламентов, регулирующих обращение медицинских изделий в Европейском Союзе, возник ряд требований, которые производители обязаны выполнять, если они хотят продавать свою медицинскую продукцию в Европе. Одно из этих требований - наличие базового UDI-DI (basic UDI-DI). Разберемся с тем, что такое basic UDI-DI, как его получить, и как затем он должен использоваться.
Базовый UDI-DI - это одно из новых требований европейского законодательства в области медицинских изделий, связанное с вступлением в силу европейских регламентов MDR 2017/745 и IVDR 2017/746. Необходимость получения и использования базового UDI-DI регламентирована статьей 29 MDR и статьей 26 IVDR. Согласно этим статьям, каждый производитель медицинских изделий или изделий для in vitro диагностики обязан получить basic UDI-DI, для того, чтобы легально продавать свои изделия в ЕС.

Сложности с получением базового UDI-DI?
Свяжитесь с нами прямо сейчас:
+357 22253765
info@mdrc-consulting.com
Более подробно требования, касающиеся basic UDI-DI изложены в Части C Приложения VI MDR и в Части C Приложения VI IVDR. За еще более подробной информацией можно обратиться к Руководству MDCG 2018-1.
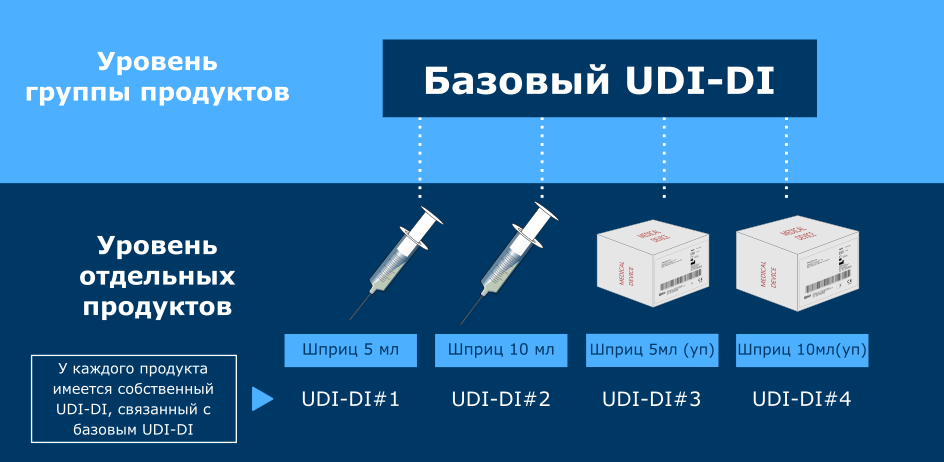
По сути, базовый UDI-DI - эти уникальный идентификатор, относящийся к отдельной группе продуктов одного производителя. Basic UDI-DI не следует путать с идентификатором UDI-DI (без слова "basic" в начале).
UDI-DI - это шифр, используемый для идентификации отдельных медицинских продуктов или отдельных упаковок этих продуктов. Система UDI-DI уже некоторое время используется в США, а с недавнего времени (со вступления в силу MDR и IVDR) была внедрена и в Европейском Союзе. Важно понимать, что UDI-DI и базовый UDI-DI - это разные идентификаторы, и используются они с разными целями. Basic UDI-DI уникален для Европы.
Согласно MDR имеется несколько специальных организаций (issuing entities), которые аккредитованы Европейским Союзом на выдачу basic UDI-DI. Европейская Комиссия аккредитовала четыре таких организации.
Для того чтобы получить базовый UDI-DI, необходимо использовать стандарты шифрования, разработанные одной из данных организаций (issuing entitiy). Чтобы сделать это, необходимо обратиться в одну из организаций.
Базовый UDI-DI представляет собой буквенно-цифровой код, состоящий из нескольких частей. Разберем устройство basic UDI-DI на примере идентификатора, составленного по стандартам GS1.

Первая часть basic UDI-DI, составленного по стандартам GS1, представляет собой префикс компании, который GS1 выдает при регистрации компании в электронной системе. Далее следует код, который производитель присваивает группе продуктов, используя свои собственные стандарты. Последние два знака basic UDI-DI генерируются с помощью специального калькулятора, предназначенного для создания и верификации базовых UDI-DI.
Базовый UDI-DI присваивается не отдельным продуктам, а группам продуктов, объединенных определенными признаками. Таким образом, для присвоения basic UDI-DI необходимо прежде всего сгруппировать продукты - каждая группа получит собственный идентификатор. Группировка продукции - задача производителя.
Для того чтобы продукты могли быть объединены в одну группу они должны:
Базовый UDI-DI является важной частью продуктовой документации и документации производителя. Он приводится:
Помимо этого, базовый UDI-DI используется при регистрации продукции в системе EUDAMED, а также при взаимодействиях с нотифицированными организациями.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
С появлением новых европейских регламентов, регулирующих обращение медицинских изделий в Европейском Союзе, возник ряд требований, которые производители обязаны выполнять, если они хотят продавать свою медицинскую продукцию в Европе. Одно из этих требований - наличие базового UDI-DI (basic UDI-DI). Разберемся с тем, что такое basic UDI-DI, как его получить, и как затем он должен использоваться.
Базовый UDI-DI - это одно из новых требований европейского законодательства в области медицинских изделий, связанное с вступлением в силу европейских регламентов MDR 2017/745 и IVDR 2017/746. Необходимость получения и использования базового UDI-DI регламентирована статьей 29 MDR и статьей 26 IVDR. Согласно этим статьям, каждый производитель медицинских изделий или изделий для in vitro диагностики обязан получить basic UDI-DI, для того, чтобы легально продавать свои изделия в ЕС.

Сложности с получением базового UDI-DI?
Свяжитесь с нами прямо сейчас:
+357 22253765
info@mdrc-consulting.com
Более подробно требования, касающиеся basic UDI-DI изложены в Части C Приложения VI MDR и в Части C Приложения VI IVDR. За еще более подробной информацией можно обратиться к Руководству MDCG 2018-1.
По сути, базовый UDI-DI - эти уникальный идентификатор, относящийся к отдельной группе продуктов одного производителя. Basic UDI-DI не следует путать с идентификатором UDI-DI (без слова "basic" в начале).
UDI-DI - это шифр, используемый для идентификации отдельных медицинских продуктов или отдельных упаковок этих продуктов. Система UDI-DI уже некоторое время используется в США, а с недавнего времени (со вступления в силу MDR и IVDR) была внедрена и в Европейском Союзе. Важно понимать, что UDI-DI и базовый UDI-DI - это разные идентификаторы, и используются они с разными целями. Basic UDI-DI уникален для Европы.

Согласно MDR имеется несколько специальных организаций (issuing entities), которые аккредитованы Европейским Союзом на выдачу basic UDI-DI. Европейская Комиссия аккредитовала четыре таких организации.
Для того чтобы получить базовый UDI-DI, необходимо использовать стандарты шифрования, разработанные одной из данных организаций (issuing entitiy). Чтобы сделать это, необходимо обратиться в одну из организаций.
Базовый UDI-DI представляет собой буквенно-цифровой код, состоящий из нескольких частей. Разберем устройство basic UDI-DI на примере идентификатора, составленного по стандартам GS1.

Первая часть basic UDI-DI, составленного по стандартам GS1, представляет собой префикс компании, который GS1 выдает при регистрации компании в электронной системе. Далее следует код, который производитель присваивает группе продуктов, используя свои собственные стандарты. Последние два знака basic UDI-DI генерируются с помощью специального калькулятора, предназначенного для создания и верификации базовых UDI-DI.
Базовый UDI-DI присваивается не отдельным продуктам, а группам продуктов, объединенных определенными признаками. Таким образом, для присвоения basic UDI-DI необходимо прежде всего сгруппировать продукты - каждая группа получит собственный идентификатор. Группировка продукции - задача производителя.
Для того чтобы продукты могли быть объединены в одну группу они должны:
Базовый UDI-DI является важной частью продуктовой документации и документации производителя. Он приводится:
Помимо этого, базовый UDI-DI используется при регистрации продукции в системе EUDAMED, а также при взаимодействиях с нотифицированными организациями.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Мы будем рады обсудить ваш новый проект!