Производители медицинских изделий, стремящиеся выйти на рынок Коста-Рики, должны обеспечить соответствие своей продукции стандартам этого государства и зарегистрировать свою продукцию в национальных регуляторных органах.
Регистрация и контроль медицинских изделий в Коста-Рике находится в ведении Министерства здравоохранения Коста-Рики - Ministerio de Salud de Costa Rica.
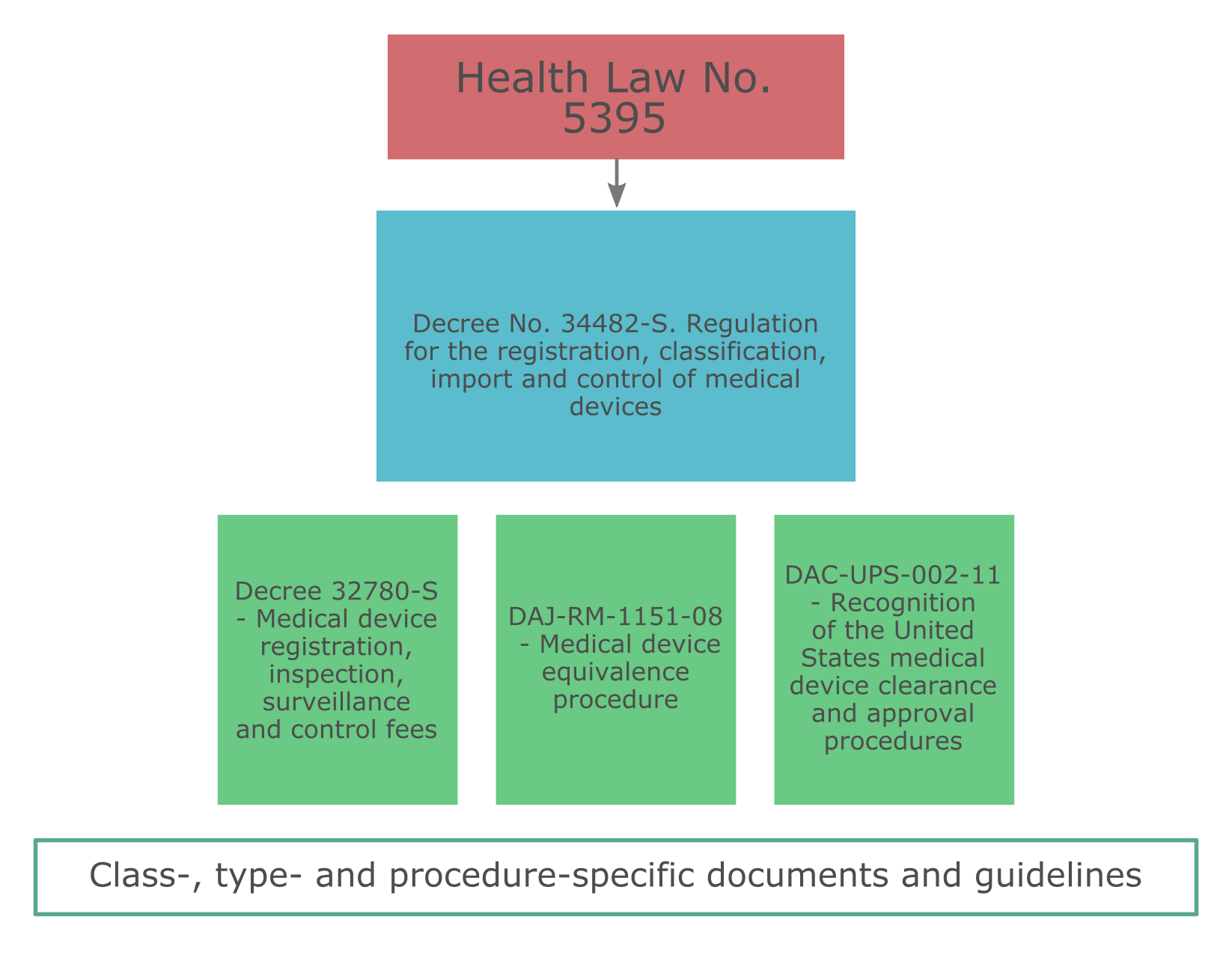
Регулирование рынка медицинской продукции в Коста-Рике осуществляется посредством ряда нормативно-правовых актов:
В Коста-Рике медицинские изделия подпадают под определение «Биомедицинского оборудования и материалов» (Equipo y material biomédico - EMB).
EMB определяется как инструмент, устройство, оборудование, материал, программное обеспечение или другое изделие, используемое отдельно или в комбинации, предназначенное производителем для использования на людях с любой из следующих целей: диагностика, профилактика, контроль, лечение, облегчение или компенсация заболевания, травмы или дефекта; исследование, замена или изменение анатомических структур или физиологических процессов; контроль зачатия. При этом продукт выполняет свою функцию не за счет фармакологических, иммунологических или метаболических механизмов.
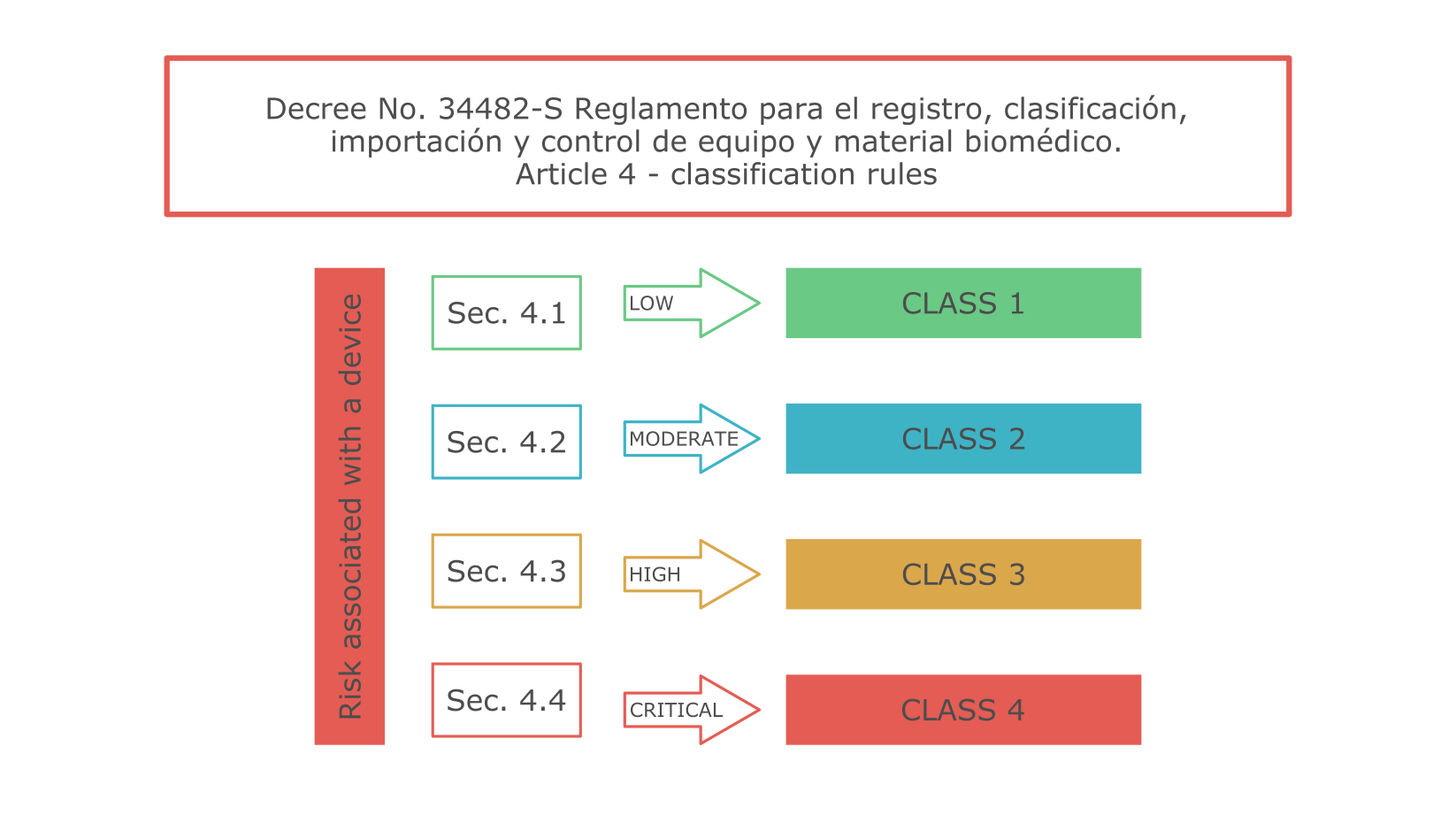
Система классификации медицинских изделий Коста-Рики сходна с таковой Health Canada. Правила классификации изложены в статье 4 Правил регистрации, классификации, импорта и контроля медицинских изделий (Указ № 34482-S).
Медицинские изделия класса 1 в Коста-Рике освобождены от процедуры регистрации. Для продуктов класса 2 существует упрощенная процедура. К изделиям классов 3 и 4 предъявляются более строгие требования. Например, для них требуется представление клинических данных, а процедура регистрации сложнее и дольше.
Для изделий классов 3 и 4, одобренных FDA, имеется упрощенная процедура регистрации, схожая с процедурой для класса 2.
Документы, необходимые для регистрации медицинского изделия, приводятся в постановлении Министерства Здравоохранения Para el registro de Equipo y Material Biomédico (EMB). Регистрационные досье имеют свои особенности в зависимости от классов продукции.
В дополнение к перечисленным выше документам:
Помимо документов, подаваемых для всех классов:
Маркировка должна быть на испанском языке или включать испанскую версию.
Помимо документов, подаваемых для всех классов:
Министерство Здравоохранения Коста-Рики рассматривает регистрационную документацию в два этапа:
Заявитель подает в Министерство здравоохранения заявку на регистрацию с некоторыми из регистрационных документов, приведенных выше.
Полнота и соответствие документации требованиям законодательства оценивается в течение пятнадцати дней для изделий класса 2 и в течение тридцати дней для изделий классов 3 и 4.
Если результат проверки положительный, заявитель получает Свидетельство о Прохождении Этапа 1.
Заявитель подает полное регистрационное досье и Свидетельство о Прохождении Этапа 1 (в другое подразделение Министерства Здравоохранения Коста-Рики). Если по результатам технической оценки устанавливается соответствие медицинского изделия требованиям Министерства Здравоохранения, заявитель получает Сертификат Регистрации, действительный в течение 5 лет.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Производители медицинских изделий, стремящиеся выйти на рынок Коста-Рики, должны обеспечить соответствие своей продукции стандартам этого государства и зарегистрировать свою продукцию в национальных регуляторных органах.
Регистрация и контроль медицинских изделий в Коста-Рике находится в ведении Министерства здравоохранения Коста-Рики - Ministerio de Salud de Costa Rica.
Регулирование рынка медицинской продукции в Коста-Рике осуществляется посредством ряда нормативно-правовых актов:

В Коста-Рике медицинские изделия подпадают под определение «Биомедицинского оборудования и материалов» (Equipo y material biomédico - EMB).
EMB определяется как инструмент, устройство, оборудование, материал, программное обеспечение или другое изделие, используемое отдельно или в комбинации, предназначенное производителем для использования на людях с любой из следующих целей: диагностика, профилактика, контроль, лечение, облегчение или компенсация заболевания, травмы или дефекта; исследование, замена или изменение анатомических структур или физиологических процессов; контроль зачатия. При этом продукт выполняет свою функцию не за счет фармакологических, иммунологических или метаболических механизмов.
Система классификации медицинских изделий Коста-Рики сходна с таковой Health Canada. Правила классификации изложены в статье 4 Правил регистрации, классификации, импорта и контроля медицинских изделий (Указ № 34482-S).
Медицинские изделия класса 1 в Коста-Рике освобождены от процедуры регистрации. Для продуктов класса 2 существует упрощенная процедура. К изделиям классов 3 и 4 предъявляются более строгие требования. Например, для них требуется представление клинических данных, а процедура регистрации сложнее и дольше.
Для изделий классов 3 и 4, одобренных FDA, имеется упрощенная процедура регистрации, схожая с процедурой для класса 2.

Документы, необходимые для регистрации медицинского изделия, приводятся в постановлении Министерства Здравоохранения Para el registro de Equipo y Material Biomédico (EMB). Регистрационные досье имеют свои особенности в зависимости от классов продукции.
В дополнение к перечисленным выше документам:
Помимо документов, подаваемых для всех классов:
Маркировка должна быть на испанском языке или включать испанскую версию.
Помимо документов, подаваемых для всех классов:
Министерство Здравоохранения Коста-Рики рассматривает регистрационную документацию в два этапа:
Заявитель подает в Министерство здравоохранения заявку на регистрацию с некоторыми из регистрационных документов, приведенных выше.
Полнота и соответствие документации требованиям законодательства оценивается в течение пятнадцати дней для изделий класса 2 и в течение тридцати дней для изделий классов 3 и 4.
Если результат проверки положительный, заявитель получает Свидетельство о Прохождении Этапа 1.
Заявитель подает полное регистрационное досье и Свидетельство о Прохождении Этапа 1 (в другое подразделение Министерства Здравоохранения Коста-Рики). Если по результатам технической оценки устанавливается соответствие медицинского изделия требованиям Министерства Здравоохранения, заявитель получает Сертификат Регистрации, действительный в течение 5 лет.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Мы будем рады обсудить ваш новый проект!