Иностранные производители медицинских изделий, стремящиеся вывести свою продукцию на рынок Перу, прежде всего должны пройти процедуру регистрации их продуктов. Понимание регуляторных процедур Перу - ключ к успеху при регистрации медицинских изделий.
Основным регуляторным органом, отвечающим за надзор за обращением медицинских изделий в Перу, является DIGEMID - Dirección General de Medicamentos, Insumos y Drogas. DIGEMID является частью Министерства здравоохранения Перу - Ministerio de Salud (MINSA).
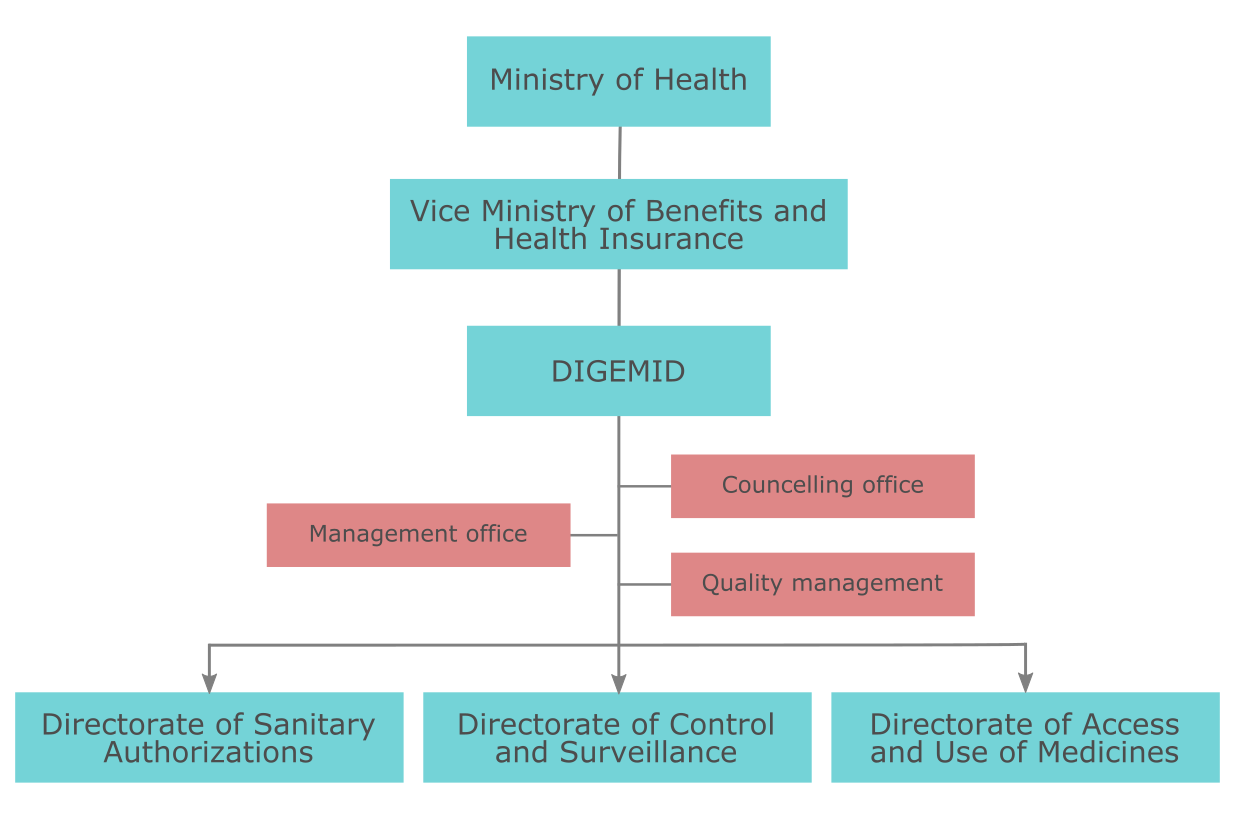
За регистрацию мединских изделий в Перу отвечает соответствующее подразделение DIGEMID - Директорат по Авторизации (Directorate of Sanitary Authorizations). Это подразделение принимает решения относительно одобрения того или иного медицинского изделия или отказа в одобрении. Основные функции Директората включают:
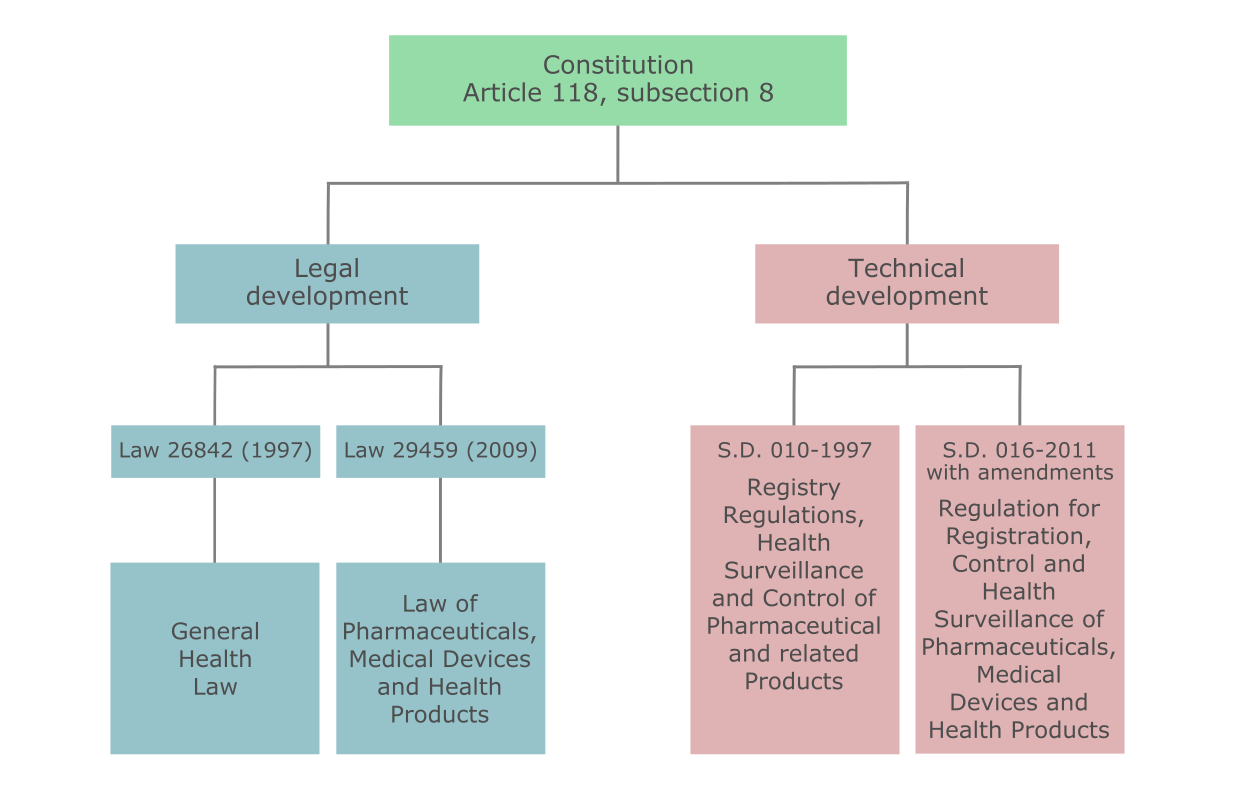
Основным законодательным актом Перу, регулирующим регистрацию медицинских изделий, является Закон No. 29459 (Закон о Лекарственных Средствах, Медицинских Изделиях и Продукции для Заботы о Здоровье). Другой важный документ - Постановление No. 016-2013-SA (Регистрация, Контроль и Надзор в Области Лекарственных Средств, Медицинских Изделий и Продукции для Заботы о Здоровье). Существует также несколько дальнейших стандартов, регламентирующих обращение медицинских изделий.
В Перу медицинским изделием считается: любые инструменты, оборудование, реактивы, калибраторы, программное обеспечение, которые предназначены для использования для таких целей, как:
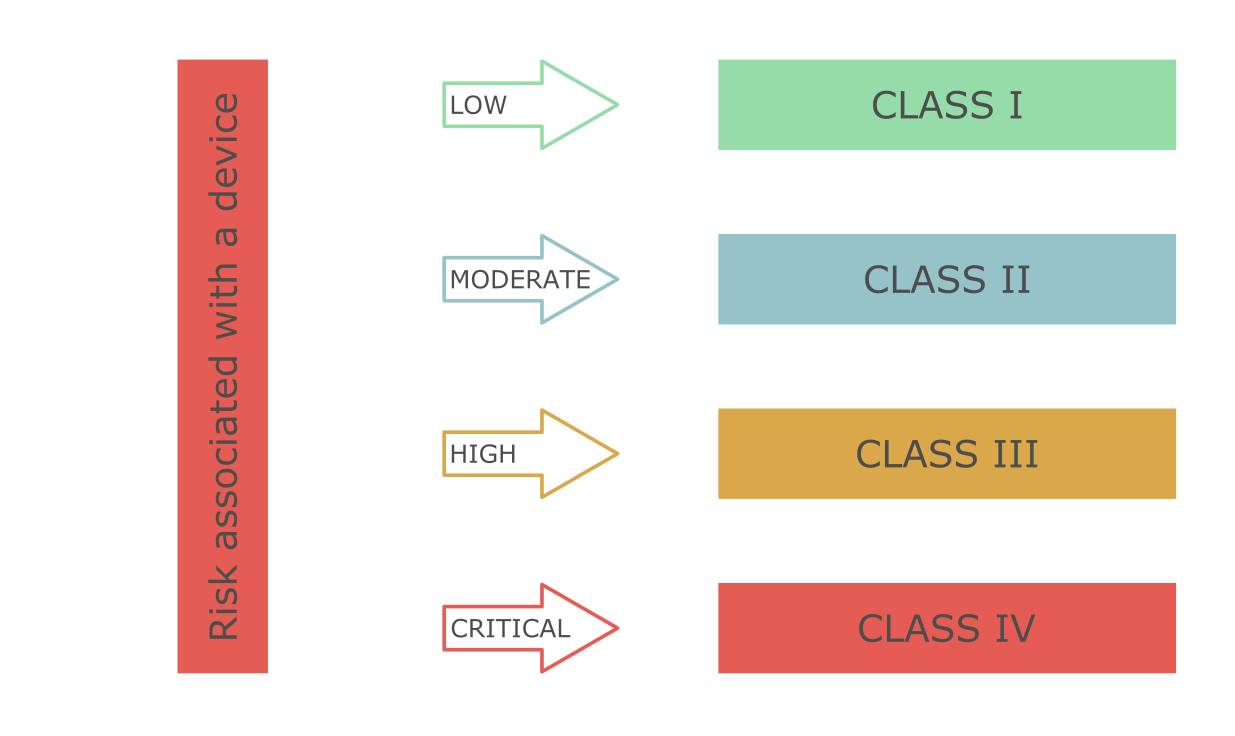
В Перу выделяют четыре класса медицинских изделий. В основе классификации лежат риски, связанные с применением медицинского изделия в т.ч. длительность его контакта с телом человека, инвазивность, а также локальные и системные эффекты медицинского изделия. Перуанская классификация медицинских изделий опирается на руководство IMDRF (стандарт GHTF).
В соответствии с требованиями Закона 29459, производитель медицинских изделий для регистрации своей продукции должен предоставить следующую информацию:
| Требования | Класс I | Класс II | Класс III | Класс IV |
|---|---|---|---|---|
| Заявление | ✔ | ✔ | ✔ | ✔ |
| CFS/CFG или аналог | ✔ | ✔ | ✔ | ✔ |
| Сертификат СМК | ✔ | ✔ | ✔ | ✔ |
| Технический отчет | ✔ | ✔ | ✔ | ✔ |
| Инструкции по применению | ✔ | ✔ | ✔ | ✔ |
| Стандарты качества и безопасности (FDA/CE) | ✔ | ✔ | ✔ | |
| Макеты этикеток | ✔ | ✔ | ✔ | ✔ |
| Программа пострегистрационного (постмаркетингового) надзора | ✔ | ✔ | ||
| Анализ рисков | ✔ | ✔ | ✔ | |
| Список стран, где изделие продается | ✔ | |||
| Клиническая оценка | ✔ | ✔ | ||
| Техническая информация | ✔ | ✔ | ✔ | |
| Биологическая безопасность | ✔ | ✔ |
Официальные сроки рассмотрения документации медицинских изделий DIGEMID составляют:
Размеры пошлины:
DIGEMID применяет систему электронного документооборота VUCE (Систему Одного Окна для Внешней Торговли). Эта система облегчает коммуникацию между DIGEMID и производителями медицинских изделий. Через эту систему можно направлять регулятору запросы, получать консультации и советы. Значительное число формальностей могут быть пройдены с использованием системы VUCE.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Иностранные производители медицинских изделий, стремящиеся вывести свою продукцию на рынок Перу, прежде всего должны пройти процедуру регистрации их продуктов. Понимание регуляторных процедур Перу - ключ к успеху при регистрации медицинских изделий.
Основным регуляторным органом, отвечающим за надзор за обращением медицинских изделий в Перу, является DIGEMID - Dirección General de Medicamentos, Insumos y Drogas. DIGEMID является частью Министерства здравоохранения Перу - Ministerio de Salud (MINSA).

За регистрацию мединских изделий в Перу отвечает соответствующее подразделение DIGEMID - Директорат по Авторизации (Directorate of Sanitary Authorizations). Это подразделение принимает решения относительно одобрения того или иного медицинского изделия или отказа в одобрении. Основные функции Директората включают:
Основным законодательным актом Перу, регулирующим регистрацию медицинских изделий, является Закон No. 29459 (Закон о Лекарственных Средствах, Медицинских Изделиях и Продукции для Заботы о Здоровье). Другой важный документ - Постановление No. 016-2013-SA (Регистрация, Контроль и Надзор в Области Лекарственных Средств, Медицинских Изделий и Продукции для Заботы о Здоровье). Существует также несколько дальнейших стандартов, регламентирующих обращение медицинских изделий.

В Перу медицинским изделием считается: любые инструменты, оборудование, реактивы, калибраторы, программное обеспечение, которые предназначены для использования для таких целей, как:
В Перу выделяют четыре класса медицинских изделий. В основе классификации лежат риски, связанные с применением медицинского изделия в т.ч. длительность его контакта с телом человека, инвазивность, а также локальные и системные эффекты медицинского изделия. Перуанская классификация медицинских изделий опирается на руководство IMDRF (стандарт GHTF).

В соответствии с требованиями Закона 29459, производитель медицинских изделий для регистрации своей продукции должен предоставить следующую информацию:
Официальные сроки рассмотрения документации медицинских изделий DIGEMID составляют:
Размеры пошлины:
DIGEMID применяет систему электронного документооборота VUCE (Систему Одного Окна для Внешней Торговли). Эта система облегчает коммуникацию между DIGEMID и производителями медицинских изделий. Через эту систему можно направлять регулятору запросы, получать консультации и советы. Значительное число формальностей могут быть пройдены с использованием системы VUCE.
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Мы будем рады обсудить ваш новый проект!