Если вы как производитель медицинских изделий стремитесь экспортировать свою продукцию и получить доступ к рынкам США, Бразилии, Канады, Японии и Австралии, вам безусловно имеет смысл рассмотреть возможность участия в программе MDSAP (единая унифицированная программа аудита системы качества). Дело в том, что каждая из указанных стран требует от производителей изделий медицинского назначения имплементации Системы Менеджмента Качества (СМК), соответствующей ее национальным требованиям. И регулятор, отвечающий за медицинские изделия, каждой страны проводит инспекцию СМК для установления ее соответствия этим требованиям. Пять стран, пять аудитов. Каждый аудит занимает немало времени. Каждый требует подготовки. Однако с 2017 года у компаний есть возможность пройти всего один аудит и получить сертификат, признаваемый регуляторами всех приведенных стран. Данная статья объясняет, что такое Medical Device Single Audit Program (MDSAP). Как работает эта программа. И каковы ее «за и против».
Единая унифицированная программа аудита системы качества MDSAP - это международная программа, обеспечивающая единый стандартизированный подход к инспектированию СМК производителей изделий медицинского назначения. Если вы участвуете в программе, вам достаточно пройти инспекцию один раз, и вы получите сертификат, действующий в США, Канаде, Бразилии, Японии и Австралии. Соответственно, национальными агентствами, признающими сертификаты MDSAP являются:
Таким образом, схема «пять стран, пять аудитов» превращается в схему «пять стран, один аудит».
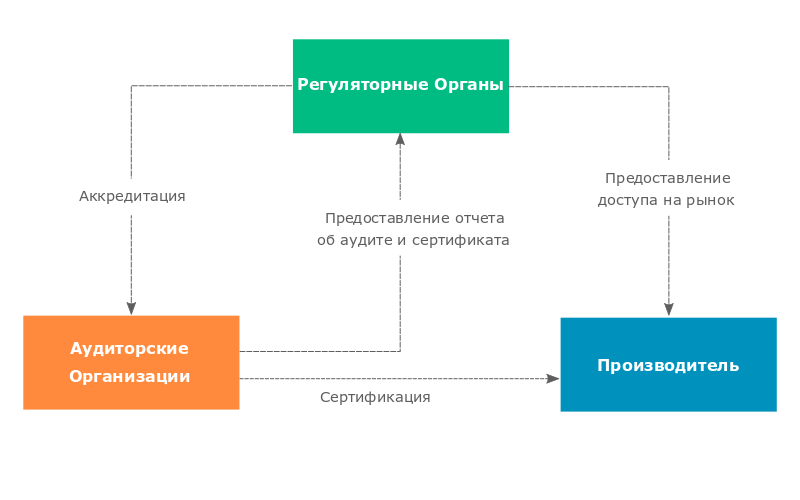
Аудит системы менеджмента качества по программе MDSAP осуществляется не самими агентствами указанных стран, а независимыми Аудиторскими Организациями (АО), аккредитованными на проведение инспекций MDSAP. В отличие от инспекций регуляторов, аудиты MDSAP планируются самими производителями. Это дает им возможность подойти к инспекции полностью подготовленными.
Другим позитивным моментом является то, что аудиторская модель MDSAP не сильно отличается от таковой для ISO 13485 с небольшими дополнениями, направленными на достижения соответствий национальным требованиям каждой из стран. Поэтому, если ваша система качества была готова к инспекциям по ISO 13485 и отдельных национальных агентств еще до того, как вы узнали о программе MDSAP, отдельной подготовки к аудиту MDSAP вам не потребуется. При этом инспекции MDSAP по своей организации похожи на аудиты по ISO 13485. Если вы проходили такой аудит, то у вас уже есть представления о том, что такое Medical Device Single Audit Program, и инспекция по MDSAP для вас не будет радикально новым опытом.
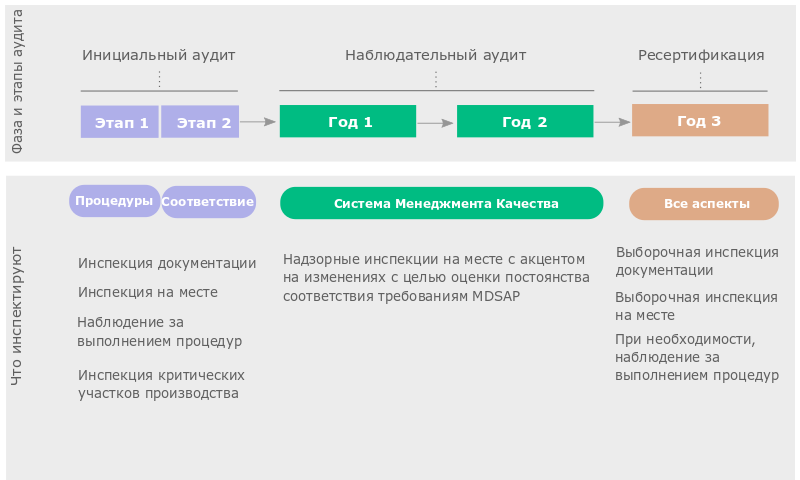
Аудиты MDSAP делятся на три фазы:
Каждая из указанных фаз может быть разделена на отдельные этапы.
Инициальный аудит делится на два этапа. Этап 1 включает инспекцию ваших процедур и документации СМК. Этап 2 предполагает анализ соответствия вашей СМК требованиям MDSAP. По результатам инициального аудита производитель получает сертификат MDSAP.
Надзорный аудит длится в течение двух лет. Он призван оценить вашу СМК в динамике и уделяет особое внимание изменениям, происходящим в вашей системе качества. Если Аудиторская Организация выявляет существенные отклонения в работе СМК, действие сертификата может быть приостановлено.
Ресертификация осуществляется на третий год после инициального аудита. Она охватывает все те аспекты, которые инспектировались во время инициального и надзорного аудитов, и направлена на установление постоянства соответствия системы качества установленным требованиям.
При оценке указанных функций аудитора, в первую очередь, интересуют следующие аспекты:
Плюсы участия в программе MDSAP:
Минусы программы MDSAP:
Стоимость - аудит MDSAP стоит значительно больше, чем любой из аудитов, проводимых национальными агентствами. Но в сумме стоимость пяти отдельных аудитов оказывается больше или сопоставимой со стоимостью MDSAP.
Ресурсы - прохождение инспекций MDSAP требует вовлечения большого числа работников из разных подразделений организации. Отдельные этапы аудита могут длиться 10 и более дней, и на это время вашим работникам придется оторваться от своих рутинных обязанностей и полностью посвятить себя прохождению аудита.
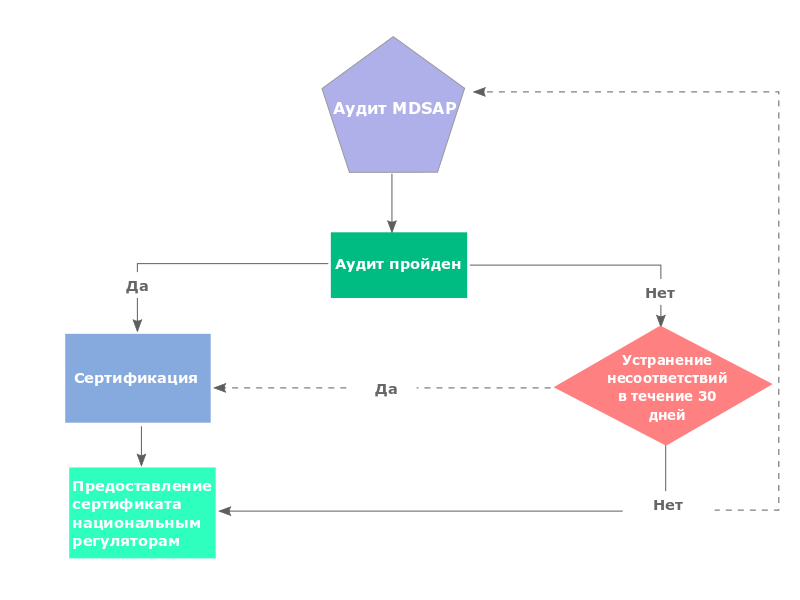
Для того, чтобы пройти аудит MDSAP, следует предпринять 7 шагов:
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Если вы как производитель медицинских изделий стремитесь экспортировать свою продукцию и получить доступ к рынкам США, Бразилии, Канады, Японии и Австралии, вам безусловно имеет смысл рассмотреть возможность участия в программе MDSAP (единая унифицированная программа аудита системы качества). Дело в том, что каждая из указанных стран требует от производителей изделий медицинского назначения имплементации Системы Менеджмента Качества (СМК), соответствующей ее национальным требованиям. И регулятор, отвечающий за медицинские изделия, каждой страны проводит инспекцию СМК для установления ее соответствия этим требованиям. Пять стран, пять аудитов. Каждый аудит занимает немало времени. Каждый требует подготовки. Однако с 2017 года у компаний есть возможность пройти всего один аудит и получить сертификат, признаваемый регуляторами всех приведенных стран. Данная статья объясняет, что такое Medical Device Single Audit Program (MDSAP). Как работает эта программа. И каковы ее «за и против».
Единая унифицированная программа аудита системы качества MDSAP - это международная программа, обеспечивающая единый стандартизированный подход к инспектированию СМК производителей изделий медицинского назначения. Если вы участвуете в программе, вам достаточно пройти инспекцию один раз, и вы получите сертификат, действующий в США, Канаде, Бразилии, Японии и Австралии. Соответственно, национальными агентствами, признающими сертификаты MDSAP являются:
Таким образом, схема «пять стран, пять аудитов» превращается в схему «пять стран, один аудит».
Аудит системы менеджмента качества по программе MDSAP осуществляется не самими агентствами указанных стран, а независимыми Аудиторскими Организациями (АО), аккредитованными на проведение инспекций MDSAP. В отличие от инспекций регуляторов, аудиты MDSAP планируются самими производителями. Это дает им возможность подойти к инспекции полностью подготовленными.
Другим позитивным моментом является то, что аудиторская модель MDSAP не сильно отличается от таковой для ISO 13485 с небольшими дополнениями, направленными на достижения соответствий национальным требованиям каждой из стран. Поэтому, если ваша система качества была готова к инспекциям по ISO 13485 и отдельных национальных агентств еще до того, как вы узнали о программе MDSAP, отдельной подготовки к аудиту MDSAP вам не потребуется. При этом инспекции MDSAP по своей организации похожи на аудиты по ISO 13485. Если вы проходили такой аудит, то у вас уже есть представления о том, что такое Medical Device Single Audit Program, и инспекция по MDSAP для вас не будет радикально новым опытом.

Аудиты MDSAP делятся на три фазы:
Каждая из указанных фаз может быть разделена на отдельные этапы.
Инициальный аудит делится на два этапа. Этап 1 включает инспекцию ваших процедур и документации СМК. Этап 2 предполагает анализ соответствия вашей СМК требованиям MDSAP. По результатам инициального аудита производитель получает сертификат MDSAP.
Надзорный аудит длится в течение двух лет. Он призван оценить вашу СМК в динамике и уделяет особое внимание изменениям, происходящим в вашей системе качества. Если Аудиторская Организация выявляет существенные отклонения в работе СМК, действие сертификата может быть приостановлено.
Ресертификация осуществляется на третий год после инициального аудита. Она охватывает все те аспекты, которые инспектировались во время инициального и надзорного аудитов, и направлена на установление постоянства соответствия системы качества установленным требованиям.

При оценке указанных функций аудитора, в первую очередь, интересуют следующие аспекты:

Плюсы участия в программе MDSAP:
Минусы программы MDSAP:
Стоимость - аудит MDSAP стоит значительно больше, чем любой из аудитов, проводимых национальными агентствами. Но в сумме стоимость пяти отдельных аудитов оказывается больше или сопоставимой со стоимостью MDSAP.
Ресурсы - прохождение инспекций MDSAP требует вовлечения большого числа работников из разных подразделений организации. Отдельные этапы аудита могут длиться 10 и более дней, и на это время вашим работникам придется оторваться от своих рутинных обязанностей и полностью посвятить себя прохождению аудита.
Для того, чтобы пройти аудит MDSAP, следует предпринять 7 шагов:
Мы здесь, чтобы помочь вам вывести вашу продукцию медицинского назначения на внешние рынки.
+357 22253765
info@mdrc-consulting.com
Мы будем рады обсудить ваш новый проект!